来源:中国新药杂志 2019年第28卷第14期
作者:吴兆伟,王铁松,王琳,付晖,张喆,吴斌,胡琴
北京市药品检验所
中药成分分析与生物评价北京市重点实验室
摘要
目的:
研究尼可地尔的生物药剂学分类(BCS),并对原研和仿制的原料药溶解性及渗透性进行评价。
方法:
采用μDissTM型和μFluxTM型光纤药物溶解性、渗透性测试系统,测定尼可地尔原料药的溶解度、固有溶出速率、有效渗透性和LogD7.4值,分析药物的BCS分类,并考察原研企业与仿制企业原料药的差异。
结果:
尼可地尔为高溶解性药物,在酸性介质中溶解度较高。
在pH6.8磷酸盐缓冲液中测得的有效渗透率,以及由LogD7.4计算出的LogP值均低于美托洛尔,为低渗透性药物。
原研企业和仿制企业原料药的溶解度、固有溶出速率、有效渗透性和LogD7.4基本一致。
结论:
尼可地尔为BCS第三类药物。
通过比较原研企业与仿制企业原料药的关键参数,可为药物的体外溶出行为评价和体内外相关性研究提供数据支撑。
关键词
尼可地尔;溶解性;渗透性;生物药剂学分类系统;仿制药一致性评价
正文
生物药剂学分类系统(Biopharmaceuticsclassificationsystem,BCS)是根据药物的溶解性及渗透性进行分类的科学体系,是预测药物体内外相关性的重要工具,在新药研发、仿制药注册申请、生产工艺放大和变更以及上市后药品评价等方面有重要应用。
当前,越来越多的监管机构在药品研究和申报过程中都接受了BCS的概念,其中FDA,WHO和EMA发布的指导原则最具权威性。
我国在仿制药一致性评价中发布了关于豁免人体生物等效性(bioequivalence,BE)试验的指导原则,要求在申请豁免或简化BE时提供生物药剂学分类信息,但由于分类标准和数据来源不同,常出现BCS分类结果不一致的情况,给实际应用造成混淆和困惑,因此进行BCS精准分类研究,是仿制药一致性评价中急需解决的技术难题。
尼可地尔属硝酸酯类化合物,作为一种三磷酸腺苷(adenosinetriphosphate,ATP)敏感性钾通道开放剂,主要用于治疗冠心病和心绞痛。
FDA和WHO已公布的部分药物BCS分类结果中,均未收载该品种。
BCS的提出者Amidon教授建立的数据库中,尼可地尔为BCS第三类,即高溶解性、低渗透性药物,但另有研究指出,尼可地尔在大鼠肠道内有较好的吸收,而根据BCS理论,吸收程度与药物的渗透性呈正相关,已有的渗透性判定与大鼠体内的吸收结果相互矛盾。
因此,考察尼可地尔的溶解性和渗透性,并进一步明确其BCS分类,是保障一致性评价工作顺利进行的关键。
本研究率先采用人工仿生膜技术,测定尼可地尔的有效渗透性,并结合溶解度和油水分配系数(LogD,LogP)测定结果,对尼可地尔的BCS分类进行判定。
通过比较原研企业与仿制企业尼可地尔原料药的溶解度、固有溶出速率和渗透性的差异,可为进一步开展仿制药体外溶出行为评价和体内外相关性研究提供数据支撑。
1材料与方法
1.1 试药
酒石酸美托洛尔对照品(中国食品药品检定研究院,批号:100084-201403,含量:99.9%);
原研企业尼可地尔原料药(批号:16F060,含量:100.0%)、仿制企业A尼可地尔原料药(批号:C014-161101)和仿制企业B尼可地尔原料药(批号:20170204)均来源于2017年国家药品抽验计划;
胃肠道模拟脂质体(美国PionInc.公司,批号:520426);ASB缓冲液(Acceptorsinkconditionedbuffer,美国PionInc.公司,批号:520407);
甲醇为色谱纯;磷酸二氢钾、氯化钠、氢氧化钠、盐酸和乙酸等均为分析纯;水为自制超纯水。
本研究所用pH1.2盐酸溶液、pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液,均参照《普通口服固体制剂溶出曲线测定与比较指导原则》中的附录配制。
1.2 仪器
μDissTM光纤药物溶解性测定仪和μDissTM光纤药物渗透性测定仪(美国PionInc公司);SevenCompactpH计与XA205电子分析天平(MettlerToledo公司);MilliQ实验室超纯水系统(MerckMillipore公司)。
1.3 溶解度测定
采用μDissTM光纤药物溶解性测定仪,分别量取pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水20mL,置于样品杯中,加入过量的尼可地尔,温度为37℃,搅拌速度为200r·min-1,采集时间24h,采样间隔60s,在250~350nm紫外波长范围内,采用光纤探头分别测定药物溶解度。
1.4 固有溶出速率测定
取不同原料5~10mg至压片模具中,1000psi压力下加压1min后取出,取载药模具一起放入样品杯中,缓慢加入20mL实验介质(pH1.2盐酸溶液、pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液),温度为37℃,搅拌速度为150r·min-1,采集时间30min,采样间隔30s,在250~350nm紫外波长范围内采用光纤探头分别测定药物浓度。
1.5 有效渗透性测定
采用平行人工膜实验测定尼可地尔在被动转运中的有效渗透性,测定装置如图1所示。

该装置分为供体室和受体室(均为20mL),中间由仿生膜隔开。
由于人体中空腹肠液pH6.5,血液pH7.4,因此本研究中为了使渗透性的测定条件接近人体胃肠道环境,同时兼顾溶出曲线的测定,参照日本橙皮书和《普通口服固体制剂溶出曲线测定与比较指导原则》,选择pH6.8的磷酸盐缓冲液作为实验介质。
供体室代表胃肠道,加入pH6.8磷酸盐缓冲液; 受体室代表血液,加入pH7.4的ASB缓冲液;中间的仿生膜代表胃肠道细胞膜,涂以胃肠道模拟脂质体。
精密量取pH6.8磷酸盐缓冲液和ASB缓冲液各20mL,分别置于供体室和受体室中,两室间以面积为1.54cm2仿生膜(20μL脂溶液浸润)隔离。
取尼可地尔适量,用甲醇溶解并稀释制成每1mL含尼可地尔20mg的溶液,作为供试品溶液。
分别精密量取供试品溶液200μL,置于供体室中,温度为37℃,搅拌速度为200r·mn-1,采集时间4h,采样间隔60s,在250~350nm紫外波长范围内,采用光纤探头分别测定药物浓度,按式(1)计算药物的渗透性:
式中Pe为有效渗透性(cm·s-1);Ct为供体室中药物的初始浓度(μg·mL-1);dc/dt为单位时间内受体室中药物浓度的变化速率(μg·mL-1·min-1);V为受体室缓冲液体积(mL);A为膜面积(cm2)。
1.6 LogD值测定
取尼可地尔适量,用甲醇溶解并稀释制成每1mL含尼可地尔10mg的溶液,作为供试品溶液。
精密量取pH7.4磷酸盐缓冲液15mL,置于样品杯中,加入80μL尼可地尔供试品溶液,混匀,沿壁缓慢加入4mL正辛醇饱和的pH7.4磷酸盐缓冲液(10∶1,振摇30min,静置24h后使用),温度为37℃,搅拌速度为150r·min-1,采集时间6h,采样间隔10s,在250~350nm紫外波长范围内,采用光纤探头分别测定药物浓度。
1.7 统计分析
数据分析采用AuPROTM软件(美国PionInc公司),二阶导数法校正后进行线性回归。
统计分析采用SPSS13.0软件的单因素方差分析,对实验数据进行显著性检验。
2结果
2.1 尼可地尔溶解度和固有溶出速率研究
经测定,尼可地尔原料药在pH1.2的酸性介质中溶解度最高(见图2)。
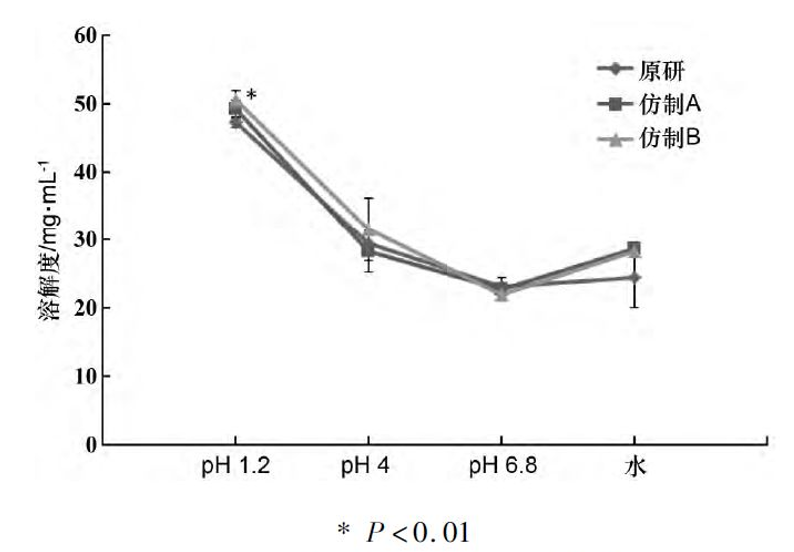
在47.2~50.6mg·mL-1之间,随着pH的升高,溶解度明显降低;在pH4.0,6.8和水中溶解度为21.9~31.6mg·mL-1。
经单因素方差分析,仿制企业B的尼可地尔原料药与原研企业相比,在pH1.2中的溶解度显著增加,在其他介质中,所有企业的溶解度均无显著性差异。
尼可地尔在不同pH值介质中的固有溶出速率测定结果如图3所示。
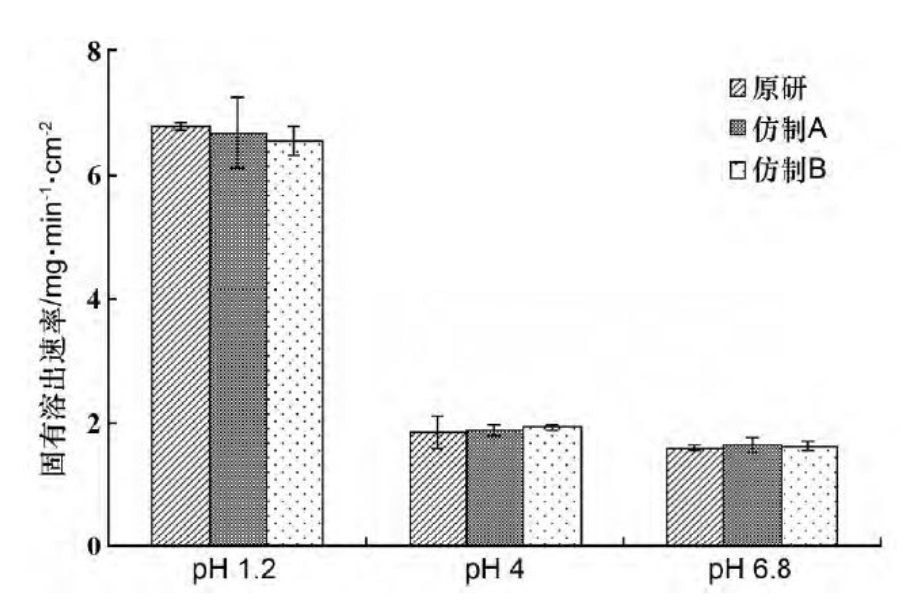
经单因素方差分析,原研企业和仿制企业A,B的尼可地尔原料药在pH1.2,4.0和6.8中的固有溶出速率无显著性差异,且在pH1.2中的固有溶出速率最高,在6.6~6.8mg·min-1·cm-2之间;在pH4.0和pH6.8中的固有溶出速率在1.6~1.9mg·min-1·cm-2之间。药物的固有溶出速率与溶解度呈正比。
2.2 尼可地尔渗透性研究
美托洛尔在pH6.5磷酸盐缓冲液和等渗条件下,在人体的近端空肠中单相测定的有效渗透性为1.34×10-4cm·s-1。
本研究中,取酒石酸美托洛尔对照品,采用“5”装置测得在pH6.8磷酸盐缓冲液中被动转运的有效渗透性为1.20×10-4cm·s-1(n=3),与文献[15]报道基本一致。
由此可见,本研究中采用体外模型来模拟人体小肠环境测得的药物渗透性结果,接近人体小肠灌流实验测得的结果,体外建模成功,且测定结果准确,可应用于药物的渗透性研究。
尼可地尔在pH6.8中的渗透性测定结果如图4所示。
随着检测时间的增加,药物逐渐通过模拟的胃肠道细胞膜,由供体室转移到受体室中,根据式(1)可计算出尼可地尔的有效渗透性。
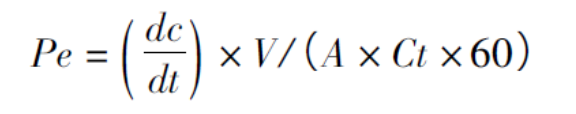
经单因素方差分析,原研企业和仿制企业A,B的尼可地尔原料药在pH6.8中的有效渗透性无显著性差异,分别为3.45×10-6,4.31×10-6和2.87×10-6cm·s-1(n=3),均低于美托洛尔在相同条件下测得的有效渗透性数值。
2.3 尼可地尔LogD,LogP值研究
LogP为化合物油水分配系数(partitioncoefficient,P)的对数值,LogD是特定pH下的分布系数,随着分子性质的变化而改变。
pH7.4时的LogD一般被认为是药物在血浆中的亲油性反映。
由测定结果可知,原研企业和仿制企业A,B的尼可地尔原料药,在pH7.4中的LogD值(LogD7.4)分别为0.63,0.62和0.63。
油水分配系数是化合物在正辛醇和水中浓度的比值,与吸收过程呈正相关。
通常P给出的是中性化合物在两相间的分配系数,对于可电离度化合物,考虑到不同pH条件下化合物的存在状态不同,使用分布系数D(distributioncoefficient)来表示所有存在形式的化合物(离子与分子形式)在两相间的分配平衡。
日本“橙皮书”中报道尼可地尔的pKa为3.2,属弱碱性化合物,其LogD和LogP值存在如下式的关系:
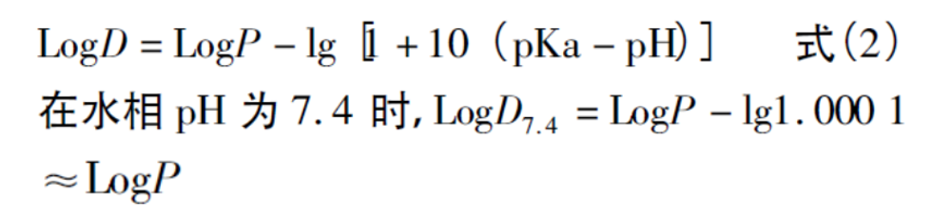
本研究中测得的尼可地尔LogD7.4为0.63(以原研的原料药数值为代表),由公式推算可知,LogP值为0.63,低于已有报道的美托洛尔的LogP值1.88。
3讨论
3.1 尼可地尔的BCS分类研究
BCS是1995年由Amidon等[1]提出的一个分类概念,根据药物的溶解性和渗透性特点将药物分为4类:第一类为高溶解性、高渗透性药物;第二类为低溶解性、高渗透性药物;第三类为高溶解性、低渗透性药物;第四类为低溶解性、低渗透性药物。
该系统将药物的溶出度、溶解度和肠道渗透性结合考虑,认为三者是影响药物吸收程度和速度的主要因素。
BCS对高溶解性的定义为:在37℃条件下,药物的最大使用剂量能完全溶解于规定pH值范围内的不大于250mL的水溶性介质中[3-5]。
通过计算药物的最大给药剂量与溶解度的比值,可判断药物溶解性的高低。
若比值≤250mL,则为高溶解性药物;反之则为低溶解性药物。
本研究中,尼可地尔片规格为5mg,单次口服剂量为5mg,以此作为药物的最大给药剂量。
由尼可地尔溶解度测定结果可知,其在pH6.8中溶解度最低,为21.9mg·mL-1,以此作为药物的溶解度。
经计算可知,尼可地尔的最大给药剂量与溶解度的比值为0.2mL,小于250mL,为高溶解性药物。
BCS对于高渗透性的定义为:在没有证据表明药物在胃肠道不稳定的情况下,制剂口服后吸收程度≥85%即认为该药具有高渗透性[3-5]。
渗透性的高低可通过与同一方法测得的美托洛尔的数值进行比较,高于美托洛尔的为高渗透性药物,反之则为低渗透性药物。
本研究中测得的尼可地尔被动转运的有效渗透性为3.45×10-6cm·s-1(以原研的原料药数值为代表),低于酒石酸美托洛尔被动转运的有效渗透性1.34×10-4cm·s-1,因此尼可地尔在被动转运中为低渗透性药物。
此外,由测得的尼可地尔LogD7.4值可推算出尼可地尔的LogP值为0.63,低于美托洛尔的LogP值1.88,因此尼可地尔通过LogP值也可判定为低渗透性药物。
综合尼可地尔溶解度、渗透性和LogP值结果,可初步判断尼可地尔为BCS第三类,即高溶解性、低渗透性药物。
BCS以吸收程度定义渗透性,认为吸收程度与渗透性具有很好的相关性,但并没有区分药物在体内的不同吸收途径,如细胞旁路通道、被动跨膜转运、载体协助跨膜转运等,具有一定的局限性[15]。
因此,在实际使用中要注意,根据渗透性预测的吸收程度并不等同于生物利用度,要进一步研究尼可地尔在人体内的渗透与吸收情况,还需通过人体或动物实验来验证。
3.2 溶解性、渗透性分析在仿制药一致性评价中的应用
我国的仿制药质量与疗效一致性评价工作中,要求仿制制剂与参比制剂在人体内具有生物等效,而BE试验成本高、耗时长,失败风险较大,因此根据《人体生物等效性试验豁免指导原则》规定,符合条件的药物在申请豁免或简化BE时,要提供生物药剂学分类信息,以及高溶解性和高渗透性的支持数据,但并未明确使用何种测定方法。
测定药物溶解度的传统方法为摇瓶法,本研究中将摇瓶法与原位光纤在线检测技术相结合,能实时监测化合物的溶解行为,与摇瓶法相比,可节约大量时间与成本,且具有较好的数据重现性。
由研究结果可知,原研企业和仿制企业A,B的尼可地尔原料药溶解度和固有溶出速率基本一致,其中在pH1.2介质中,仿制企业B的溶解度与原研企业相比增加了7%,且差异显著。
对原料药的溶解情况进行研究,可为后续的尼可地尔片体外溶出行为评价提供有益的参考。
药物渗透性测定方法包括体内药动学方法或体外渗透性方法,即人体试验、动物体内实验和体外实验。
尽管人体小肠灌流法是最直接的测量渗透性的方法,但由于人体试验操作复杂,成本高,因此到目前为止仅有Lennernas等[17]于2007年发表的29种药物的人体小肠渗透性数据可作为准确的判断依据。
Caco-2和MDCK等单层细胞模型可用来模拟药物通过肠壁的渗透情况,在制药行业中有很高的接受度,但细胞生长周期相对较长(21d),培养过程中细胞可能被污染,不同实验室间的测定结果差异较大,在介质pH的选择以及使用与生理相关的介质时存在一定的局限性。
本研究中所用的技术,是基于人工过滤膜支撑的体外渗透性模型(PAMPA),这个模型能够快速检测药物通过被动扩散机制的膜渗透率,最短在1h内可获得药物的渗透性数据,并且可以避免复杂的细胞实验,重复性高且价格便宜。虽然模型内在的局限性体现在于缺乏主动和旁路转运机制,但绝大多数(95%)口服固体制剂是通过被动转运被吸收的,所以该方法适用范围广,测定准确性高。
已有研究证实,人工膜渗透性测定结果与人体小肠灌流法测定的渗透性结果呈正相关,相关系数为0.83。
此外,Avdeef等通过比较PAMPA与Caco-2细胞模型,证明了PAMPA可一定程度上替代细胞模型。
基于尼可地尔的BCS分类结果,可预测药物在体内的溶出和吸收行为,通过合理的实验设计,建立适合的体外溶出方法,并找到和体内药-时曲线有最佳关联的体外溶出条件,通过该溶出条件下的溶出行为评价,比较仿制药与参比制剂的一致性,进而搭建体内外相关性模型,预测药物的体内吸收,并对生物等效性风险进行评价。
但是,同一药物可能会因分类标准和测定方法的不同,而具有多种BCS分类结果,因此研究药物的BCS分类时,还要考虑药物的吸收部位、吸收机制、处方中辅料组成以及治疗指数等方面的影响,进行更为全面的评估。